化工进展 ›› 2022, Vol. 41 ›› Issue (2): 938-950.DOI: 10.16085/j.issn.1000-6613.2021-0531
代谢工程改造大肠杆菌生产琥珀酸
唐文秀1,2( ), 王学明1,2, 郭亮1,2, 季立豪1,2, 高聪1,2, 陈修来1,2, 刘立明1,2(
), 王学明1,2, 郭亮1,2, 季立豪1,2, 高聪1,2, 陈修来1,2, 刘立明1,2( )
)
- 1.江南大学食品科学与技术国家重点实验室,江苏 无锡 214122
2.江南大学国际食品安全联合实验室,江苏 无锡 214122
-
收稿日期:2021-03-16修回日期:2021-04-16出版日期:2022-02-05发布日期:2022-02-23 -
通讯作者:刘立明 -
作者简介:唐文秀(1995—),女,硕士研究生,研究方向为发酵工学。E-mail:1607498550@qq.com 。 -
基金资助:广东省重点领域研发计划(2019B020218001);国家重点研发计划(2020YFA0908550);国家科学基金创新研究群体科学基金(32021005);国家轻工技术与工程一流学科自主课题(LITE2018-08)
Metabolic engineering of Escherichia coli to produce succinic acid
TANG Wenxiu1,2( ), WANG Xueming1,2, GUO Liang1,2, JI Lihao1,2, GAO Cong1,2, CHEN Xiulai1,2, LIU Liming1,2(
), WANG Xueming1,2, GUO Liang1,2, JI Lihao1,2, GAO Cong1,2, CHEN Xiulai1,2, LIU Liming1,2( )
)
- 1.State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi 214122, Jiangsu, China
2.International Joint Laboratory on Food Safety, Jiangnan University, Wuxi 214122, Jiangsu, China
-
Received:2021-03-16Revised:2021-04-16Online:2022-02-05Published:2022-02-23 -
Contact:LIU Liming
摘要:
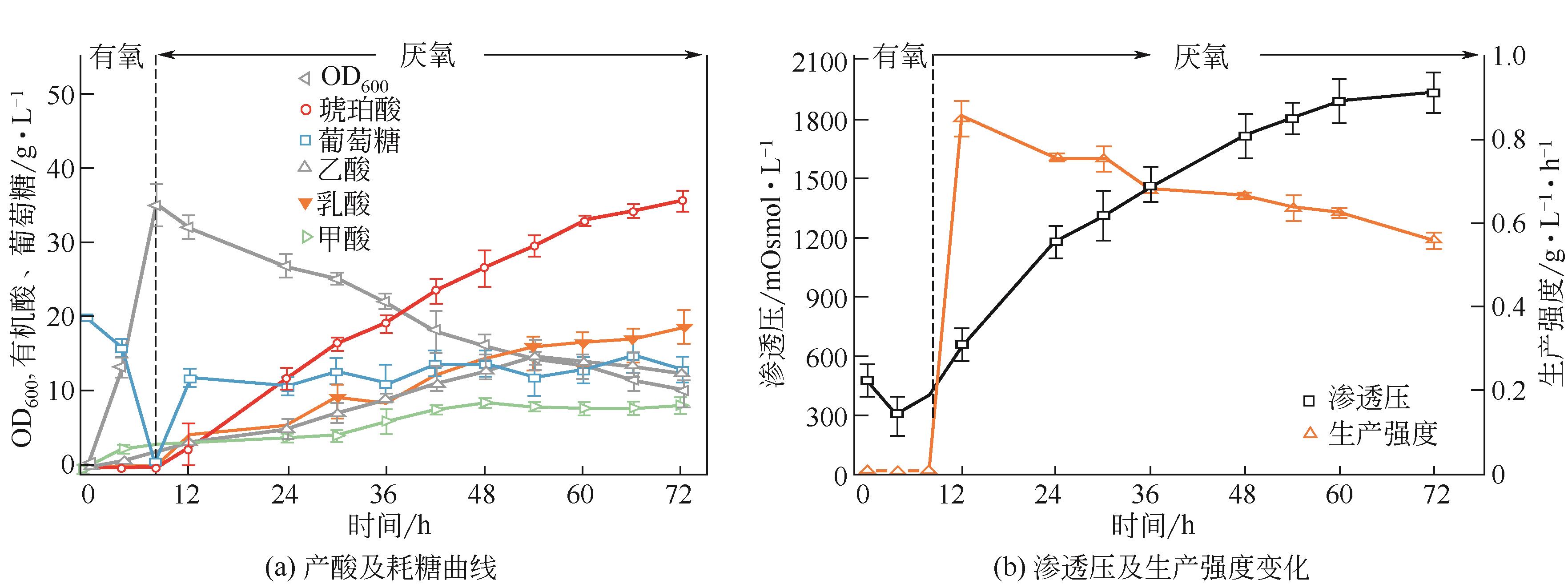
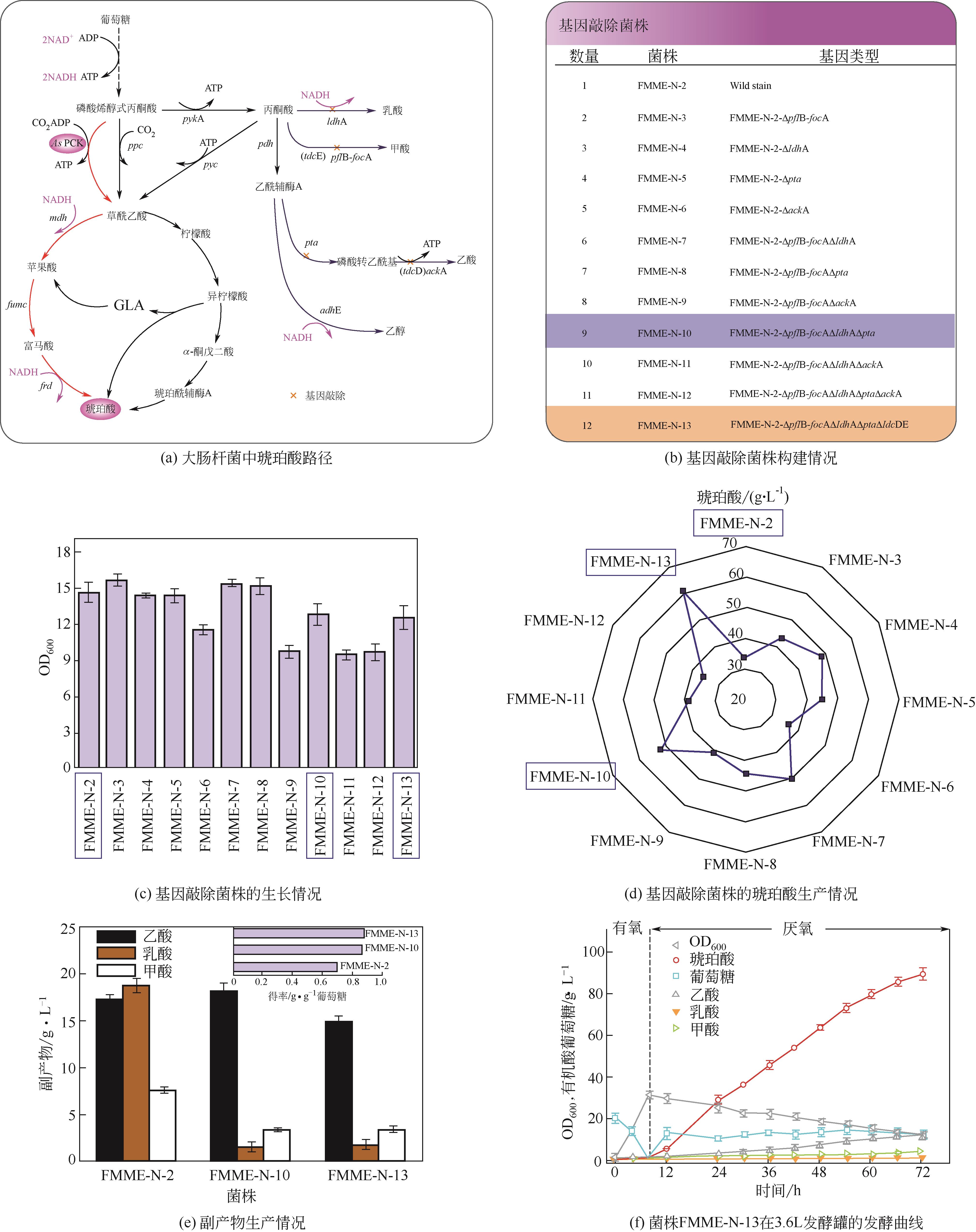
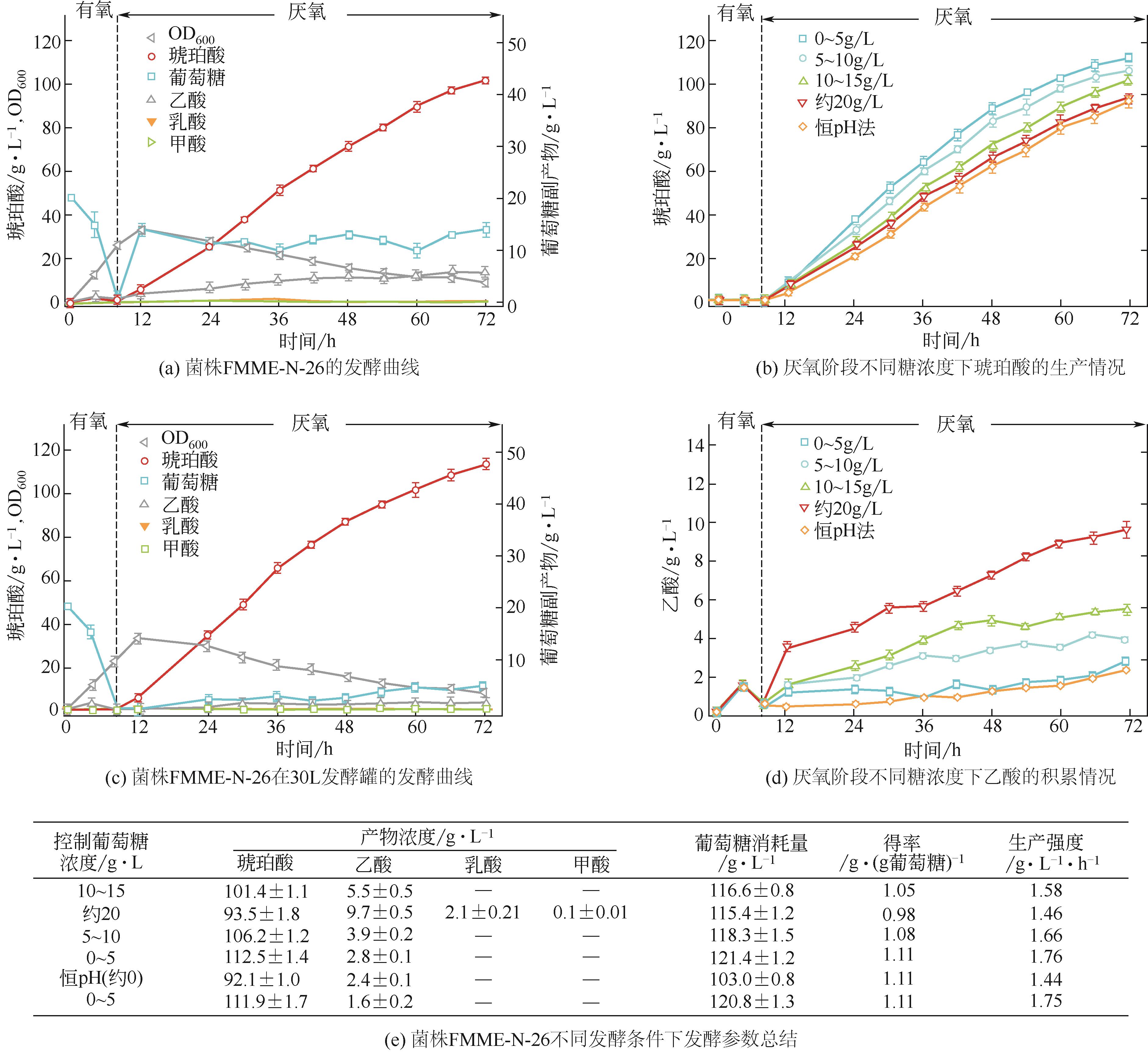
琥珀酸(succinic acid)是一种四碳二羧酸,在食品、医药、塑料和化工行业具有广泛的应用。目前,微生物法生产琥珀酸存在得率低、生产强度低、副产物积累等问题。为此,本研究通过复合诱变(ARTP和60Co-γ射线)筛选到一株耐高渗突变株FMME-N-2,其琥珀酸得率为0.70g/g葡萄糖,同时积累18.8g/L乳酸、7.6g/L甲酸和17.3g/L乙酸。为了提高琥珀酸得率,通过敲除乳酸脱氢酶基因(ldhA)、丙酮酸-甲酸裂解酶-甲酸转运蛋白基因(pflB-focA)、磷酸转乙酰基基因(pta)、丙酸激酶基因(tdcD)和a-酮丁酸甲酸酯裂解酶基因(tdcE),阻断冗余代谢支路减少副产物积累,获得工程菌株FMME-N-13,琥珀酸得率增加到0.92g/g葡萄糖,同时副产物大大降低,积累0.6g/L乳酸、3.6g/L甲酸和12.3g/L乙酸。同时,通过调控RBS强度组合优化来自产琥珀酸放线杆菌的磷酸烯醇式丙酮酸羧激酶基因(AsPCK)和来自博伊丁假丝酵母的甲酸脱氢酶基因(CbFDH)的表达水平,调控胞内ATP和NADH的浓度,最优工程菌FMME-N-26(FMME-N-13-L-AsPCK-L-CbFDH)的琥珀酸得率增加至1.04g/g葡萄糖,仅积累5.5g/L乙酸;最终,对厌氧阶段葡萄糖浓度进行优化,当葡萄糖浓度控制在0~5g/L时,菌株FMME-N-26的琥珀酸浓度增加到111.9g/L,得率为1.11g/g葡萄糖(理论产率的99%),生产强度为1.76g/L/h,为琥珀酸的工业化生产奠定了良好的基础。
中图分类号:
引用本文
唐文秀, 王学明, 郭亮, 季立豪, 高聪, 陈修来, 刘立明. 代谢工程改造大肠杆菌生产琥珀酸[J]. 化工进展, 2022, 41(2): 938-950.
TANG Wenxiu, WANG Xueming, GUO Liang, JI Lihao, GAO Cong, CHEN Xiulai, LIU Liming. Metabolic engineering of Escherichia coli to produce succinic acid[J]. Chemical Industry and Engineering Progress, 2022, 41(2): 938-950.
| 菌株/质粒 | 相关特性 | 来源 |
|---|---|---|
| 质粒 | ||
| pKD4 | oriR6Kγ,Kan,rgnB(Ter) | 本研究室 |
| pKD46 | pSC101ts ori,bla,PBAD,gam,bet,exo | 本研究室 |
| pCP20 | pSC101ts ori,Cm,Flp | 本研究室 |
| pETM6R1 | ColE1 ori,Amp,PTac | 本研究构建 |
| pETM6R1-AsPCK | ColE1 ori,Amp,PTac,AsPCK | 本研究构建 |
| pETM6R1-CbFDH | ColE1 ori,Amp,PTac,CbFDH | 本研究构建 |
| pETM6R1-AsPCK- CbFDH | ColE1 ori,Amp,PTac,AsPCK,CbFDH, | 本研究构建 |
| pETM6R1-RBS10(H)-AsPCK-RBS09(M)-CbFDH | ColE1 ori,Amp,PTac,AsPCK,CbFDH,RBS10,RBS09 | 本研究构建 |
| pETM6R1-RBS10(H)-AsPCK-RBS03(L)-CbFDH | ColE1 ori,Amp,PTac,AsPCK,CbFDH,RBS10,RBS03 | 本研究构建 |
| pETM6R1-H-AsPCK-H-CbFDH | ColE1 ori,Amp,PTac,AsPCK,CbFDH,RBS10,RBS10 | 本研究构建 |
| pETM6R1-M-AsPCK-M-CbFDH | ColE1 ori,Amp,PTac,AsPCK,CbFDH,RBS09,RBS09 | 本研究构建 |
| pETM6R1-M-AsPCK-L-CbFDH | ColE1 ori,Amp,PTac,AsPCK,CbFDH,RBS09,RBS03 | 本研究构建 |
| pETM6R1-M-AsPCK-H-CbFDH | ColE1 ori,Amp,PTac,AsPCK,CbFDH,RBS09,RBS10 | 本研究构建 |
| pETM6R1-L-AsPCK-M-CbFDH | ColE1 ori,Amp,PTac,AsPCK,CbFDH,RBS03,RBS09 | 本研究构建 |
| pETM6R1-L-AsPCK-L-CbFDH | ColE1 ori,Amp,PTac,AsPCK,CbFDH,RBS03,RBS03 | 本研究构建 |
| pETM6R1-L-AsPCK-H-CbFDH | ColE1 ori,Amp,PTac,AsPCK,CbFDH,RBS03,RBS10 | 本研究构建 |
| 菌株 | ||
| E. coli JM109 | General cloning host | Addgene |
| E. coli FMME-N | Wild type screened from rumen of camel(preservation number,CCTCC M2018568) | 本研究室 |
| FMME-N-1 | After ARTP mutagenesis breeding from FMME-N | 本研究室筛选 |
| FMME-N-2 | After60Co-γ irradiation mutagenesis breeding from FMME-N-1 | 本研究室筛选 |
| FMME-N-3 | FMME-N-2 ΔpflB-focA | 本研究构建 |
| FMME-N-4 | FMME-N-2 ΔldhA | 本研究构建 |
| FMME-N-5 | FMME-N-2 Δpta | 本研究构建 |
| FMME-N-6 | FMME-N-2 ΔackA | 本研究构建 |
| FMME-N-7 | FMME-N-2 ΔpflB-focAΔldhA | 本研究构建 |
| FMME-N-8 | FMME-N-2 ΔpflB-focAΔpta | 本研究构建 |
| FMME-N-9 | FMME-N-2 ΔpflB-focAΔackA | 本研究构建 |
| FMME-N-10 | FMME-N-2 ΔpflB-focAΔldhAΔpta | 本研究构建 |
| FMME-N-11 | FMME-N-2 ΔpflB-focAΔldhAΔackA | 本研究构建 |
| FMME-N-12 | FMME-N-2 ΔpflB-focAΔldhAΔptaΔackA | 本研究构建 |
| FMME-N-13 | FMME-N-2 ΔpflB-focAΔldhAΔptaΔtdcDΔtdcE | 本研究构建 |
| FMME-N-14 | FMME-N-13 pETM6R1-AsPCK | 本研究构建 |
| FMME-N-15 | FMME-N-13 pETM6R1-CbFDH | 本研究构建 |
| FMME-N-16 | FMME-N-13 pETM6R1-AsPCK-CbFDH | 本研究构建 |
| FMME-N-17 | FMME-N-13 pETM6R1-H-AsPCK-M-CbFDH | 本研究构建 |
| FMME-N-18 | FMME-N-13 pETM6R1-H-AsPCK-L-CbFDH | 本研究构建 |
| FMME-N-19 | FMME-N-13 pETM6R1-H-AsPCK-H-CbFDH | 本研究构建 |
| FMME-N-20 | FMME-N-13 pETM6R1-M-AsPCK-M-CbFDH | 本研究构建 |
| FMME-N-21 | FMME-N-13 pETM6R1-M-AsPCK-L-CbFDH | 本研究构建 |
| FMME-N-22 | FMME-N-13 pETM6R1-M-AsPCK-H-CbFDH | 本研究构建 |
| FMME-N-23 | FMME-N-13 pETM6R1-L-AsPCK-M-CbFDH | 本研究构建 |
| FMME-N-24 | FMME-N-13 pETM6R1-L-AsPCK-L-CbFDH | 本研究构建 |
| FMME-N-25 | FMME-N-13 pETM6R1-L-AsPCK-H-CbFDH | 本研究构建 |
| FMME-N-26 | FMME-N-13-L-AsPCK-L-CbFDH | 本研究构建 |
表1 本研究所使用的菌种和质粒
| 菌株/质粒 | 相关特性 | 来源 |
|---|---|---|
| 质粒 | ||
| pKD4 | oriR6Kγ,Kan,rgnB(Ter) | 本研究室 |
| pKD46 | pSC101ts ori,bla,PBAD,gam,bet,exo | 本研究室 |
| pCP20 | pSC101ts ori,Cm,Flp | 本研究室 |
| pETM6R1 | ColE1 ori,Amp,PTac | 本研究构建 |
| pETM6R1-AsPCK | ColE1 ori,Amp,PTac,AsPCK | 本研究构建 |
| pETM6R1-CbFDH | ColE1 ori,Amp,PTac,CbFDH | 本研究构建 |
| pETM6R1-AsPCK- CbFDH | ColE1 ori,Amp,PTac,AsPCK,CbFDH, | 本研究构建 |
| pETM6R1-RBS10(H)-AsPCK-RBS09(M)-CbFDH | ColE1 ori,Amp,PTac,AsPCK,CbFDH,RBS10,RBS09 | 本研究构建 |
| pETM6R1-RBS10(H)-AsPCK-RBS03(L)-CbFDH | ColE1 ori,Amp,PTac,AsPCK,CbFDH,RBS10,RBS03 | 本研究构建 |
| pETM6R1-H-AsPCK-H-CbFDH | ColE1 ori,Amp,PTac,AsPCK,CbFDH,RBS10,RBS10 | 本研究构建 |
| pETM6R1-M-AsPCK-M-CbFDH | ColE1 ori,Amp,PTac,AsPCK,CbFDH,RBS09,RBS09 | 本研究构建 |
| pETM6R1-M-AsPCK-L-CbFDH | ColE1 ori,Amp,PTac,AsPCK,CbFDH,RBS09,RBS03 | 本研究构建 |
| pETM6R1-M-AsPCK-H-CbFDH | ColE1 ori,Amp,PTac,AsPCK,CbFDH,RBS09,RBS10 | 本研究构建 |
| pETM6R1-L-AsPCK-M-CbFDH | ColE1 ori,Amp,PTac,AsPCK,CbFDH,RBS03,RBS09 | 本研究构建 |
| pETM6R1-L-AsPCK-L-CbFDH | ColE1 ori,Amp,PTac,AsPCK,CbFDH,RBS03,RBS03 | 本研究构建 |
| pETM6R1-L-AsPCK-H-CbFDH | ColE1 ori,Amp,PTac,AsPCK,CbFDH,RBS03,RBS10 | 本研究构建 |
| 菌株 | ||
| E. coli JM109 | General cloning host | Addgene |
| E. coli FMME-N | Wild type screened from rumen of camel(preservation number,CCTCC M2018568) | 本研究室 |
| FMME-N-1 | After ARTP mutagenesis breeding from FMME-N | 本研究室筛选 |
| FMME-N-2 | After60Co-γ irradiation mutagenesis breeding from FMME-N-1 | 本研究室筛选 |
| FMME-N-3 | FMME-N-2 ΔpflB-focA | 本研究构建 |
| FMME-N-4 | FMME-N-2 ΔldhA | 本研究构建 |
| FMME-N-5 | FMME-N-2 Δpta | 本研究构建 |
| FMME-N-6 | FMME-N-2 ΔackA | 本研究构建 |
| FMME-N-7 | FMME-N-2 ΔpflB-focAΔldhA | 本研究构建 |
| FMME-N-8 | FMME-N-2 ΔpflB-focAΔpta | 本研究构建 |
| FMME-N-9 | FMME-N-2 ΔpflB-focAΔackA | 本研究构建 |
| FMME-N-10 | FMME-N-2 ΔpflB-focAΔldhAΔpta | 本研究构建 |
| FMME-N-11 | FMME-N-2 ΔpflB-focAΔldhAΔackA | 本研究构建 |
| FMME-N-12 | FMME-N-2 ΔpflB-focAΔldhAΔptaΔackA | 本研究构建 |
| FMME-N-13 | FMME-N-2 ΔpflB-focAΔldhAΔptaΔtdcDΔtdcE | 本研究构建 |
| FMME-N-14 | FMME-N-13 pETM6R1-AsPCK | 本研究构建 |
| FMME-N-15 | FMME-N-13 pETM6R1-CbFDH | 本研究构建 |
| FMME-N-16 | FMME-N-13 pETM6R1-AsPCK-CbFDH | 本研究构建 |
| FMME-N-17 | FMME-N-13 pETM6R1-H-AsPCK-M-CbFDH | 本研究构建 |
| FMME-N-18 | FMME-N-13 pETM6R1-H-AsPCK-L-CbFDH | 本研究构建 |
| FMME-N-19 | FMME-N-13 pETM6R1-H-AsPCK-H-CbFDH | 本研究构建 |
| FMME-N-20 | FMME-N-13 pETM6R1-M-AsPCK-M-CbFDH | 本研究构建 |
| FMME-N-21 | FMME-N-13 pETM6R1-M-AsPCK-L-CbFDH | 本研究构建 |
| FMME-N-22 | FMME-N-13 pETM6R1-M-AsPCK-H-CbFDH | 本研究构建 |
| FMME-N-23 | FMME-N-13 pETM6R1-L-AsPCK-M-CbFDH | 本研究构建 |
| FMME-N-24 | FMME-N-13 pETM6R1-L-AsPCK-L-CbFDH | 本研究构建 |
| FMME-N-25 | FMME-N-13 pETM6R1-L-AsPCK-H-CbFDH | 本研究构建 |
| FMME-N-26 | FMME-N-13-L-AsPCK-L-CbFDH | 本研究构建 |
| 培养基 | 成分 |
|---|---|
| LB培养基 | 蛋白胨10g?L-1,酵母粉5g?L-1,氯化钠10g?L-1 |
| 固体筛选培养基 | 葡萄糖16g?L-1,酵母粉5g?L-1,蛋白胨5g?L-1,NaCl 1.5g?L-1,KH2PO4 1.16g?L-1,K2HPO4 0.5g?L-1,MgSO4·7H2O 0.3g?L-1,NaHCO3 0.4g?L-1,溴甲酚紫0.05g?L-1,琼脂粉20g?L-1,添加相应浓度的NaCl |
| 发酵培养基 | 葡萄糖20g?L-1,玉米浆5g?L-1,(NH4)2SO4 3.3g?L-1,KH2PO4 0.6g?L-1,K2HPO4 1.4g?L-1,NaCl 1g?L-1,MgSO4·7H2O 0.4g?L-1 |
| 抗生素 | 氨苄青霉素(Amp),硫酸卡那霉素(Kan),氯霉素(Chl) |
| 诱导剂 | IPTG,阿拉伯糖 |
表2 本研究所用的培养基及其抗生素
| 培养基 | 成分 |
|---|---|
| LB培养基 | 蛋白胨10g?L-1,酵母粉5g?L-1,氯化钠10g?L-1 |
| 固体筛选培养基 | 葡萄糖16g?L-1,酵母粉5g?L-1,蛋白胨5g?L-1,NaCl 1.5g?L-1,KH2PO4 1.16g?L-1,K2HPO4 0.5g?L-1,MgSO4·7H2O 0.3g?L-1,NaHCO3 0.4g?L-1,溴甲酚紫0.05g?L-1,琼脂粉20g?L-1,添加相应浓度的NaCl |
| 发酵培养基 | 葡萄糖20g?L-1,玉米浆5g?L-1,(NH4)2SO4 3.3g?L-1,KH2PO4 0.6g?L-1,K2HPO4 1.4g?L-1,NaCl 1g?L-1,MgSO4·7H2O 0.4g?L-1 |
| 抗生素 | 氨苄青霉素(Amp),硫酸卡那霉素(Kan),氯霉素(Chl) |
| 诱导剂 | IPTG,阿拉伯糖 |
| 参数 | 处理条件 |
|---|---|
| 载气 | He |
| 输出功率 | 100W |
| 辐照距离 | 2mm |
| 气体流量 | 10 SLM |
| 辐照时间 | 0s、15s、30s、45s、46s、75s、90s |
表3 ARTP处理条件
| 参数 | 处理条件 |
|---|---|
| 载气 | He |
| 输出功率 | 100W |
| 辐照距离 | 2mm |
| 气体流量 | 10 SLM |
| 辐照时间 | 0s、15s、30s、45s、46s、75s、90s |
| 引物 | 序列(5’→3’) |
|---|---|
| QC-pflB-focA-S | TTACTCCGTATTTGCATAAAAACCATGCGAGTTACGGGCCTATAAGTGTAGGCTGGAGCTGCTTC |
| QC-pflB-focA-A | ATAGATTGAGTGAAGGTACGAGTAATAACGTCCTGCTGCTGTTCTCATATGAATATCCTCCTTAG |
| QC-ldhA-S | ATGAACTCGCCGTTTTATAGCACAAAACAGTACGACAAGAAGTACGTGTAGGCTGGAGCTGCTTC |
| QC-ldhA-A | TTAAACCAGTTCGTTCGGGCAGGTTTCGCCTTTTTCCAGATTGCTCATATGAATATCCTCCTTAG |
| QC-pta-S | GTGTCCCGTATTATTATGCTGATCCCTACCGGAACCAGCGTCGGTGTGTAGGCTGGAGCTGCTTC |
| QC-pta-A | TTACTGCTGCTGTGCAGACTGAATCGCAGTCAGCGCGATGGTGTACATATGAATATCCTCCTTAG |
| QC-ackA-S | ATGTCGAGTAAGTTAGTACTGGTTCTGAACTGCGGTAGTTCTTCAGTGTAGGCTGGAGCTGCTTC |
| QC-ackA-A | TCAGGCAGTCAGGCGGCTCGCGTCTTGCGCGATAACCAGTTCTTCCATATGAATATCCTCCTTAG |
| KZ-tdcD-Up-S | AAAACTGCAGCAAAGCGCAGAATATTCCAGT |
| KZ-tdcD-Up-A/KZ-tdcD-Down-S | TCTCTACAATACTTCAACTAAACTCTTTTCTCATCCTGAGTTACG |
| KZ-tdcD-Down-A | CCGCTCGAGACATCAAATACGCCCTGGTTATG |
| TKZ-sgClpXP-F-tdcE | ACTAGTTTGTGGGAAAAAGTAATGGAGTTTTAGAGCTAGAAATAGCAAGT |
| KZ-tdcE-Up-S | AAAACTGCAGTCGCCAGCCAAACCAACCAGAG |
| KZ-tdcE-Up-A/KZ-tdcE-Down-S | CTTTTTCATACATCCTCCGGCGGAAAAATAATCTCTCTACAATAC |
| KZ-tdcD-Down-A | CCGCTCGAGTTGAAAATATCGAATGCACTAA |
| YZ-pflB-focA-S | TAAGGTTAAATATCGGTAATTTGTATTTAATAAAT |
| YZ-pflB-focA-A | TTTCTCCAGATGTGGCCCATCTGA |
| YZ-ldhA-S | TGTGGCATGTTTAACCGTTCAGTT |
| YZ-ldhA-A | TACTTTCTTCATTGTGGTTCTCAATTA |
| YZ-pta-S | CGCAACCTGGCTGCACGTTTC |
| YZ-pta-A | ATTGCGGACATAGCGCAAATATT |
YZ-ackA-S YZ-ackA-A | ATTACGCAAAATGGCATAGACTCAAG AACGCCTTTGCGTTCCATTGCAC |
| KZ-AsPCK-S | AAGAAGGAGATATACATATGGCACATGACTGACTTAAACAAACT |
| KZ-AsPCK-A | GCAGCGGTTTCTTTACCAGATTATGCTTTTGGACCGGCGCCAAC |
| KZ-CbFDH-S | AGAAGGAGATATACATATGGATGGGTAAACCAAAGGTATT |
| KZ-CbFDH-A | GCAGCGGTTTCTTTACCAGATTACTTTTTTTCTCTTTGAC |
| KZ-EcPCK-S | AGAAGGAGATATACATATGGATGCGCGTTAACAATGGTTTGA |
| KZ-EcPCK-A | GCAGCGGTTTCTTTACCAGATTACAGTTTCGGACCAGCCGCTA |
| L-AsPCK-S | GAAGATCTCTAGA |
| M-AsPCK-S | GAAGATCTCTAGA |
| H-AsPCK-S | GAAGATCTCTAGA |
| AsPCK-A | GCGAATTCTTATGCTTTTGGACCGGCGCCAAC |
| L-CbFDH-S | CGAGCTCAGACGACATAACGTTAGAAAAGAATAAGGTAGTTTCATATGGATGGGTAAACCAAAGGTAT |
| M-CbFDH-S | CGAGCTCAGATATTTAAACTATCACGACATAAGGAGGTCAGGGATATGGATGGGTAAACCAAAGGTAT |
| H-CbFDH-S | CGAGCTCAGAAAGAGGGCGCGGCAGAGAAGGAGGAGGTAAGAAATATGGATGGGTAAACCAAAGGTAT |
| CbFDH-A | GGCTCGAGTTACTTTTTTTCTCTTTGACCA |
| TKZ-sgClpXP-F-EcPCK | ATGTCATGACCCAGCTGCTCGTTTTAGAGCTAGAAATAGCAAGT |
| ZH-AsPCK-CbFDH-S | GATAAGATGGGGTGTCTGGGGTAATTTGACAATTAATCATCCGGCTCG |
| ZH-AsPCK-CbFDH-A | CACGAGGGTTTGCAGAAGAGGAAGACAAAAAACCCCTCAAGACCCGTTT |
表4 本研究所使用的引物
| 引物 | 序列(5’→3’) |
|---|---|
| QC-pflB-focA-S | TTACTCCGTATTTGCATAAAAACCATGCGAGTTACGGGCCTATAAGTGTAGGCTGGAGCTGCTTC |
| QC-pflB-focA-A | ATAGATTGAGTGAAGGTACGAGTAATAACGTCCTGCTGCTGTTCTCATATGAATATCCTCCTTAG |
| QC-ldhA-S | ATGAACTCGCCGTTTTATAGCACAAAACAGTACGACAAGAAGTACGTGTAGGCTGGAGCTGCTTC |
| QC-ldhA-A | TTAAACCAGTTCGTTCGGGCAGGTTTCGCCTTTTTCCAGATTGCTCATATGAATATCCTCCTTAG |
| QC-pta-S | GTGTCCCGTATTATTATGCTGATCCCTACCGGAACCAGCGTCGGTGTGTAGGCTGGAGCTGCTTC |
| QC-pta-A | TTACTGCTGCTGTGCAGACTGAATCGCAGTCAGCGCGATGGTGTACATATGAATATCCTCCTTAG |
| QC-ackA-S | ATGTCGAGTAAGTTAGTACTGGTTCTGAACTGCGGTAGTTCTTCAGTGTAGGCTGGAGCTGCTTC |
| QC-ackA-A | TCAGGCAGTCAGGCGGCTCGCGTCTTGCGCGATAACCAGTTCTTCCATATGAATATCCTCCTTAG |
| KZ-tdcD-Up-S | AAAACTGCAGCAAAGCGCAGAATATTCCAGT |
| KZ-tdcD-Up-A/KZ-tdcD-Down-S | TCTCTACAATACTTCAACTAAACTCTTTTCTCATCCTGAGTTACG |
| KZ-tdcD-Down-A | CCGCTCGAGACATCAAATACGCCCTGGTTATG |
| TKZ-sgClpXP-F-tdcE | ACTAGTTTGTGGGAAAAAGTAATGGAGTTTTAGAGCTAGAAATAGCAAGT |
| KZ-tdcE-Up-S | AAAACTGCAGTCGCCAGCCAAACCAACCAGAG |
| KZ-tdcE-Up-A/KZ-tdcE-Down-S | CTTTTTCATACATCCTCCGGCGGAAAAATAATCTCTCTACAATAC |
| KZ-tdcD-Down-A | CCGCTCGAGTTGAAAATATCGAATGCACTAA |
| YZ-pflB-focA-S | TAAGGTTAAATATCGGTAATTTGTATTTAATAAAT |
| YZ-pflB-focA-A | TTTCTCCAGATGTGGCCCATCTGA |
| YZ-ldhA-S | TGTGGCATGTTTAACCGTTCAGTT |
| YZ-ldhA-A | TACTTTCTTCATTGTGGTTCTCAATTA |
| YZ-pta-S | CGCAACCTGGCTGCACGTTTC |
| YZ-pta-A | ATTGCGGACATAGCGCAAATATT |
YZ-ackA-S YZ-ackA-A | ATTACGCAAAATGGCATAGACTCAAG AACGCCTTTGCGTTCCATTGCAC |
| KZ-AsPCK-S | AAGAAGGAGATATACATATGGCACATGACTGACTTAAACAAACT |
| KZ-AsPCK-A | GCAGCGGTTTCTTTACCAGATTATGCTTTTGGACCGGCGCCAAC |
| KZ-CbFDH-S | AGAAGGAGATATACATATGGATGGGTAAACCAAAGGTATT |
| KZ-CbFDH-A | GCAGCGGTTTCTTTACCAGATTACTTTTTTTCTCTTTGAC |
| KZ-EcPCK-S | AGAAGGAGATATACATATGGATGCGCGTTAACAATGGTTTGA |
| KZ-EcPCK-A | GCAGCGGTTTCTTTACCAGATTACAGTTTCGGACCAGCCGCTA |
| L-AsPCK-S | GAAGATCTCTAGA |
| M-AsPCK-S | GAAGATCTCTAGA |
| H-AsPCK-S | GAAGATCTCTAGA |
| AsPCK-A | GCGAATTCTTATGCTTTTGGACCGGCGCCAAC |
| L-CbFDH-S | CGAGCTCAGACGACATAACGTTAGAAAAGAATAAGGTAGTTTCATATGGATGGGTAAACCAAAGGTAT |
| M-CbFDH-S | CGAGCTCAGATATTTAAACTATCACGACATAAGGAGGTCAGGGATATGGATGGGTAAACCAAAGGTAT |
| H-CbFDH-S | CGAGCTCAGAAAGAGGGCGCGGCAGAGAAGGAGGAGGTAAGAAATATGGATGGGTAAACCAAAGGTAT |
| CbFDH-A | GGCTCGAGTTACTTTTTTTCTCTTTGACCA |
| TKZ-sgClpXP-F-EcPCK | ATGTCATGACCCAGCTGCTCGTTTTAGAGCTAGAAATAGCAAGT |
| ZH-AsPCK-CbFDH-S | GATAAGATGGGGTGTCTGGGGTAATTTGACAATTAATCATCCGGCTCG |
| ZH-AsPCK-CbFDH-A | CACGAGGGTTTGCAGAAGAGGAAGACAAAAAACCCCTCAAGACCCGTTT |
| 菌株 | 琥珀酸浓度/g?L-1 | ||||
|---|---|---|---|---|---|
| 第四代 | 第八代 | 第十二代 | 第十六代 | 第二十代 | |
| FMME-N | 23.2±0.1 | 21.8±0.3 | 22.3±0.2 | 21.5±0.4 | 20.2±0.5 |
| FMME-N-2 | 35.6±0.2 | 35.8±0.3 | 36.8±0.6 | 35.5±0.4 | 36.1±0.2 |
表5 FMME-N-2突变株的遗传稳定性
| 菌株 | 琥珀酸浓度/g?L-1 | ||||
|---|---|---|---|---|---|
| 第四代 | 第八代 | 第十二代 | 第十六代 | 第二十代 | |
| FMME-N | 23.2±0.1 | 21.8±0.3 | 22.3±0.2 | 21.5±0.4 | 20.2±0.5 |
| FMME-N-2 | 35.6±0.2 | 35.8±0.3 | 36.8±0.6 | 35.5±0.4 | 36.1±0.2 |
| 1 | DAI Z X, GUO F, ZHANG S J, et al. Bio-based succinic acid: an overview of strain development, substrate utilization, and downstream purification[J]. Biofuels, Bioproducts and Biorefining, 2020, 14(5): 965-985. |
| 2 | BOZELL J J, PETERSEN G R. Technology development for the production of biobased products from biorefinery carbohydrates—The US Department of Energy’s “Top 10” revisited[J]. Green Chemistry, 2010, 12(4): 539. |
| 3 | MIKA L T, CSÉFALVAY E, NÉMETH Á. Catalytic conversion of carbohydrates to initial platform chemicals: chemistry and sustainability[J]. Chemical Reviews, 2018, 118(2): 505-613. |
| 4 | GUARNIERI M T, CHOU Y C, SALVACHÚA D, et al. Metabolic engineering of actinobacillus succinogenes provides insights into succinic acid biosynthesis[J]. Applied and Environmental Microbiology, 2017, 83(17): 14-25.. |
| 5 | AHN J H, SEO H, PARK W, et al. Enhanced succinic acid production by Mannheimia employing optimal malate dehydrogenase[J]. Nature Communications, 2020, 11: 1970. |
| 6 | RAAB A M, GEBHARDT G, BOLOTINA N, et al. Metabolic engineering of Saccharomyces cerevisiae for the biotechnological production of succinic acid[J]. Metabolic Engineering, 2010, 12(6): 518-525. |
| 7 | ZHU L W, TANG Y J. Current advances of succinate biosynthesis in metabolically engineered Escherichia coli[J]. Biotechnology Advances, 2017, 35(8): 1040-1048. |
| 8 | SÁNCHEZ A M, BENNETT G N, SAN K Y. Novel pathway engineering design of the anaerobic central metabolic pathway in Escherichia coli to increase succinate yield and productivity[J]. Metabolic Engineering, 2005, 7(3): 229-239. |
| 9 | LIN H, BENNETT G N, SAN K Y. Genetic reconstruction of the aerobic central metabolism in Escherichia coli for the absolute aerobic production of succinate[J]. Biotechnology and Bioengineering, 2005, 89(2): 148-156. |
| 10 | JANTAMA K, ZHANG X L, MOORE J C, et al. Eliminating side products and increasing succinate yields in engineered strains of Escherichia coli C[J]. Biotechnology and Bioengineering, 2008, 101(5): 881-893. |
| 11 | TAN Z G, ZHU X N, CHEN J, et al. Activating phosphoenolpyruvate carboxylase and phosphoenolpyruvate carboxykinase in combination for improvement of succinate production[J]. Applied and Environmental Microbiology, 2013, 79(16): 4838-4844. |
| 12 | ZHANG X L, JANTAMA K, MOORE J C, et al. Metabolic evolution of energy-conserving pathways for succinate production in Escherichia coli[J]. Proceedings of the National Academy of Sciences, 2009, 106(48): 20180-20185. |
| 13 | VEMURI G N, EITEMAN M A, ALTMAN E. Succinate production in dual-phase Escherichia coli fermentations depends on the time of transition from aerobic to anaerobic conditions[J]. Journal of Industrial Microbiology & Biotechnology, 2002, 28(6): 325-332. |
| 14 | WEI L N, ZHU L W, TANG Y J. Succinate production positively correlates with the affinity of the global transcription factor Cra for its effector FBP in Escherichia coli[J]. Biotechnology for Biofuels, 2016, 9: 264. |
| 15 | TAN Z G, CHEN J, ZHANG X L. Systematic engineering of pentose phosphate pathway improves Escherichia coli succinate production[J]. Biotechnology for Biofuels, 2016, 9(1): 262-275. |
| 16 | ZHU X N, TAN Z G, XU H T, et al. Metabolic evolution of two reducing equivalent-conserving pathways for high-yield succinate production in Escherichia coli[J]. Metabolic Engineering, 2014, 24: 87-96. |
| 17 | JANTAMA K, HAUPT M J, SVORONOS S A, et al. Combining metabolic engineering and metabolic evolution to develop nonrecombinant strains of Escherichia coli C that produce succinate and malate[J]. Biotechnology and Bioengineering, 2008, 99(5): 1140-1153. |
| 18 | 梁丽亚, 马江锋, 刘嵘明, 等. 过量表达苹果酸脱氢酶对大肠杆菌NZH111产丁二酸的影响[J]. 生物工程学报, 2011, 27(7): 1005-1012. |
| LIANG Liya, MA Jiangfeng, LIU Rongming, et al. Effect of overexpression of malate dehydrogenase on succinic acid production in Escherichia coli NZN111[J]. Chinese Journal of Biotechnology, 2011, 27(7): 1005-1012. | |
| 19 | SEONG W, HAN G H, LIM H S, et al. Adaptive laboratory evolution of Escherichia coli lacking cellular byproduct formation for enhanced acetate utilization through compensatory ATP consumption[J]. Metabolic Engineering, 2020, 62: 249-259. |
| 20 | FERONE M, RAGANATI F, OLIVIERI G, et al. Bioreactors for succinic acid production processes[J]. Critical Reviews in Biotechnology, 2019, 39(4): 571-586. |
| 21 | HU G P, ZHOU J, CHEN X L, et al. Engineering synergetic CO2-fixing pathways for malate production[J]. Metabolic Engineering, 2018, 47: 496-504. |
| 22 | ZHANG C, SONG W, LIU J, et al. Production of enantiopure (R)-or (S)-2-hydroxy-4-(methylthio) butanoic acid by multi-enzyme cascades[J]. Bioresources and Bioprocessing, 2019, 6(1): 12-20. |
| 23 | ANDERSSON C, HELMERIUS J, HODGE D, et al. Inhibition of succinic acid production in metabolically engineered Escherichia coli by neutralizing agent, organic acids, and osmolarity[J]. Biotechnology Progress, 2009, 25(1): 116-123. |
| 24 | LIU L M, XU Q L, LI Y, et al. Enhancement of pyruvate production by osmotic-tolerant mutant of Torulopsis glabrata[J]. Biotechnology and Bioengineering, 2007, 97(4): 825-832. |
| 25 | XIAO M Y, ZHU X N, FAN F Y, et al. Osmotolerance in Escherichia coli is improved by activation of copper efflux genes or supplementation with sulfur-containing amino acids[J]. Applied and Environmental Microbiology, 2017, 83(7): e03050. |
| 26 | XIAO M Y, ZHU X N, XU H T, et al. A novel point mutation in RpoB improves osmotolerance and succinic acid production in Escherichia coli[J]. BMC Biotechnology, 2017, 17(1): 1-11. |
| 27 | ZHANG C, GOU D, MEI J, et al. Isolation of high osmotic-tolerant mutants of Escherichia coli for succinic acid production by metabolic evolution[J]. Chinese Journal of Biotechnology, 2012, 28(11): 1337-1345. |
| 28 | XU H T, ZHOU Z H, WANG C, et al. Enhanced succinic acid production in Corynebacterium glutamicum with increasing the available NADH supply and glucose consumption rate by decreasing H+-ATPase activity[J]. Biotechnology Letters, 2016, 38(7): 1181-1186. |
| 29 | LEE J W, YI J, KIM T Y, et al. Homo-succinic acid production by metabolically engineered Mannheimia succiniciproducens[J]. Metabolic Engineering, 2016, 38: 409-417. |
| 30 | CHEN X Z, ZHOU L, TIAN K M, et al. Metabolic engineering of Escherichia coli: a sustainable industrial platform for bio-based chemical production[J]. Biotechnology Advances, 2013, 31(8): 1200-1223. |
| 31 | LI J J, LI Y K, CUI Z Y, et al. Enhancement of succinate yield by manipulating NADH/NAD+ ratio and ATP generation[J]. Applied Microbiology and Biotechnology, 2017, 101(8): 3153-3161. |
| [1] | 郭超, 冯奥, 陆信曜, 宗红, 诸葛斌. 重组大肠杆菌1,2,4-丁三醇合成途径的平衡优化[J]. 化工进展, 2022, 41(12): 6531-6539. |
| [2] | 陶雨萱, 张尚杰, 景艺文, 信丰学, 董维亮, 周杰, 蒋羽佳, 章文明, 姜岷. 甲基营养型大肠杆菌构建策略的研究进展[J]. 化工进展, 2021, 40(7): 3932-3941. |
| [3] | 李阳, 朱晨辉, 范代娣. 重组胶原蛋白的绿色生物制造及其应用[J]. 化工进展, 2021, 40(3): 1262-1275. |
| [4] | 周末,刘彦君,佟欣瑞,董延甲,吴欣瑜,王迎香,应明. E. coli K-12琥珀酸脱氢酶sdhC基因纳米锥的设计及自组装[J]. 化工进展, 2020, 39(2): 679-685. |
| [5] | 王春雨,朱玲,许丹芸,罗清月. 低温等离子体降解苯的工艺参数优化[J]. 化工进展, 2020, 39(1): 402-412. |
| [6] | 陈露,刘丁玉,汪保卫,赵玉姣,贾广韬,陈涛,王智文. 大肠杆菌乙酰辅酶A代谢调控及其应用研究进展[J]. 化工进展, 2019, 38(9): 4218-4226. |
| [7] | 陈丹,张小里,李冰麟,卫龙辉,赵彬侠,张耀中. 正己烷/丙酮混合溶剂中非均相催化合成α-生育酚琥珀酸酯[J]. 化工进展, 2019, 38(9): 4095-4101. |
| [8] | 张玲, 宋祖坤, 林荣, 王男, 杨海麟. 乳糖诱导E. coli发酵生产FAD为辅基的葡萄糖脱氢酶[J]. 化工进展, 2019, 38(04): 1879-1886. |
| [9] | 宋鑫, 张双虹, 陈涛, 刘训理, 王智文. 大肠杆菌调控因子工程及其菌株耐受性研究进展[J]. 化工进展, 2018, 37(07): 2780-2789. |
| [10] | 李亿, 张红岩, 朱婧, 秦艳, 王青艳, 申乃坤. 响应面优化木糖母液发酵产丁二酸[J]. 化工进展, 2018, 37(01): 252-259. |
| [11] | 闫云涛, 毛岩鹏. 复合二氧化氯及其氯酸盐消毒副产物产生机理及影响因素[J]. 化工进展, 2017, 36(S1): 512-517. |
| [12] | 孙明荣, 刘晓欣, 谢文华, 宗保宁, 郜亮. 生物炼制经济的发展思路和展望[J]. 化工进展, 2017, 36(09): 3250-3256. |
| [13] | 李海花, 高美玲, 张利辉, 高玉华, 刘振法. 含磺酸基团的环氧琥珀酸类共聚物的合成及性能比较[J]. 化工进展, 2017, 36(04): 1491-1498. |
| [14] | 刘长高, 何忠平, 张玉苍, 席小勇. 香蕉假茎中产碱性果胶酶细菌的筛选发酵优化与酶学性质[J]. 化工进展, 2015, 34(09): 3415-3420. |
| [15] | 张慧慧, 陈环宇, 何晓芳, 周晓燕, 裘尚德, 柳景青, 胡宝兰, 楼莉萍. 饮用水管网中不同源有机污染物简析[J]. 化工进展, 2015, 34(07): 2003-2008,2030. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||